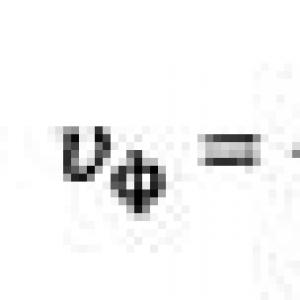Методы разделения, концентрирования и устранения мешающих анализу компонентов. Аналитическая химия К методам концентрирования относят
Курсовая работа:
Методы разделения и концентрирования в анализе элементов
Введение
Общая характеристика методов разделения
Экстракция как метод разделения
Общая характеристика методов концентрирования
Соосаждение как метод концентрирования
Заключение
Список литературы
Введение
Развитие аналитической химии идет двумя основными путями: разработка максимально селективных методов определения индивидуальных веществ и оптимальное сочетание методов разделения и концентрирования с неселективными методами определения в комбинированных методах анализа. Под селективностью метода в данном случае понимается возможность регистрации аналитического сигнала, соответствующего определяемому веществу, на фоне, создаваемом сопутствующими примесями и матрицей. Понятие комбинированные находится в полном соответствии со смысловым содержанием этого слова: соединенные вместе для достижения общей цели. Соответственно могут быть комбинированные методы разделения, в которых преследуется цель улучшения разделения, и комбинированные методы анализа, обеспечивающие оптимальное сочетание предварительного разделения с конечным определением. Широкое распространение комбинированных методов анализа, в первую очередь хроматографических, нельзя рассматривать только как следствие ограниченной селективности известных методов прямого определения веществ в объекте анализа.
Помимо важной роли методов разделения и концентрирования для комбинированных методов анализа, методы разделения имеют самостоятельную ценность при решении препаративных задач. Аналитики постоянную испытывают потребность в веществах высокой чистоты: растворителях, в первую очередь в воде, реагентах и наконец во всех тех веществах, которые анализируются ими. Задачи приготовления стандартных образцов столь же разнообразны, сколь разнообразны объекты анализа. И далеко не всегда можно воспользоваться готовыми образцами и их компонентами необходимой степени чистоты. В своих препаративных интересах аналитическая химия вплотную соприкасается с химической технологией. Методы разделения и концентрирования, разрабатываемые аналитиками, зачастую, не претерпев принципиальных изменений, реализуются в технологических процессах. При этом речь может идти как крупнотоннажных экстракционных технологиях получения редких металлов, так и о процессах в фармацевтической промышленности, в биохимических производствах, где грань между масштабами лабораторного эксперимента и промышленного производства практически отсутствует.
Общая характеристика методов разделения
Под методами разделения будем понимать совокупности характерных для них химических и физических процессов и способов их осуществления. Сам по себе процесс, например, разделения веществ между двумя жидкими фазами еще не является методом разделения. В сочетании со способом осуществления, обеспечивающим переход веществ из одной фазы в другую в результате их равновесного распределения между фазами, такой процесс станет экстракцией, а в сочетании с хроматографическим способом - жидкосножидкостной хроматографией.
Трудности при любой попытке систематизации методов разделения вносят комбинированные методы анализа. За одним названием «газовая» и «жидкостная» хроматография скрываются и методы хроматографического разделения веществ в газовой и жидкостной фазах, и соответствующие комбинированные методы.
Общепринятая классификация медов разделения и концентрирования до сих пор отсутствует. При совместном рассмотрении различных методов чаще всего приходится сталкиваться или с их простым перечислением. Или с объединением в в группы по какому-либо формальному признаку вне общей классификации. При систематизации методов разделения в простейшем случае в качестве отправной точки берут принадлежность метода к той или иной области науки, породившей его: химические, физико-химические, физические методы. Расклассифицируем методы разделения в нижеприведенных таблицах.
Таблица 1. Методы разделения, основанные на образовании выделяемым веществом новой фазы
Агрегатное состояние фазы, в которой находится исходная смесь веществАгрегатное состояние выделяемой фазыТвердое телоГазЖидкостьЖидкостьОсаждение, электроосаждение вымораживание, кристаллизацияОтгонка, дистилляция, ректификация-Газ--ВымораживаниеТвердое тело-Высокотемпературная отгонка при взаимодействии с газообразным реагентом, возгонкаСелективное растворение
Методы разделения по фазовому признаку составляют четыре группы и основаны на:
2.различии в распределении веществ между фазами;
.различиях в массопереносе, проявляющихся при индуцирумом переходе вещества из одной фазы в другую через разделяющую их третью фазу;
.механизмах внутрифазного разделения.
Для первой группы методов характерными признаками являются агрегатные состояния исходной смеси веществ и выделяемой фазы (Табл.1). Методы второй группы основаны на общих закономерностях распределения веществ между фазами и могут характеризоваться их агрегатным состоянием и способом осуществления процесса межфазного распределения. Для третьей и четвертой группы, кроме агрегатного состояния фаз, характерным признаком является природа движущих сил процесса. Значение для аналитической химии методов разделения, входящих в первую группу, далеко неоднозначно. Процессы вымораживания и жидкой и газовой фаз и селективного растворения твердой фазы применяют сравнительно редко. Вымораживание используют при анализе газов для отделения влаги, для криогенного концентрирования более высококипящих примесей. Селективное растворение применяют в двух вариантах: частичное или полное растворение матрицы и селективное растворение фаз. Примером полного растворения матрицы является растворение сталей, сплавов при определении неметаллических включений: оксидов, карбидов, нитридов. Важнейшее значение для аналитической химии имеют методы разделения, основанные на различиях в распределении веществ между фазами: экстракция, сорбция, различные хроматографические методы. Характерным признаком методов разделения этой группы, помимо системы фаз, является способ осуществления процесса межфазного разделения (табл.2)
Таблица 2. Методы разделения, основанные на различиях в распределении веществ между фазами Система фазСпособ осуществления процесса межфазного разделенияОднократное равно весное распределениеМногократное по вторение процесса распределенияхроматографияЖидкость-жидкостьЭкстракцияМногоступенчатая экстрацияЖидкостно-жидкостная хроматография с полярной и неполярной стационарными фазамиЖидкость-твердое телоСоосаждение, зонная плавка, направленныя кристаллизация, сорбция и ионный обменМногократная перекристаллизацияИонообменная, адсобционная, гель-проникающая, аффинная хроматографияЖидкость-газГазовая экстракцияБарботажГазожидкостная и жидкостно-газовая хроматографияВещество в критическом состоянии-твердое тело (жижкость)Сверхкритическая флюидная экстракцияМногоступенчатая флюидная экстракцияСверхкритическая флюидная хроматография
Экстракция как метод разделения
Из методов разделения, основанных на однократном равновесном разделении веществ, наибольшее практическое значение имеет экстракция. Экстракция является одним из наиболее надежных, весьма эффективных и распространенных методов концентрирования и разделения веществ. Исследование и применение экстракции - ведущее, быстро развивающееся направление в современной химии. Под экстракцией понимают как сам процесс распределения веществ между двумя фазами, так и метод разделения, основанный на этом процессе. В наиболее общем случае можно рассматривать фазовые равновесия в системах жидкость- жидкостей, жидкость - газ. Возможны самые различные варианты жидких фаз: вода и водные растворы, органические растворители и растворы в них других органических соединений, расплавы солей и металлов, расплавы твердых при нормальных условиях органических соединений. Метод газовой экстракции (система жидкость- газ и реже твердое тело - газ) имеет более узкое назначение - для анализа газообразных и легколетучих соединений в конденсированных фазах, и отличается от обычной экстракции только тем, что в качестве экстрагента используют газ, не мешающий аналитическому определению газообразных примесей. На распределении веществ между двумя жидкими фазами основаны многие близкие к экстракционным методы, например бумажная и колоночная распределительная хроматография. В распределительной хроматографии одна из фаз, органическая или водная, закреплена на инертном носителе, а другая движется. Этим достигается многократность обмена между фазами. Особое значение приобретает извлечение различных соединений металлов из водных растворов в несмешивающиеся с ними органические растворители. Экстракция осуществляется путем 1) приведения растворов (ионов металла и экстрагента) в контакт (смешения); 2) механического разделения фаз; 3) регенерации экстрагента. Области применения экстракции весьма разнообразны. Экстракция дает возможность отделить даже незначительные количества примесей от основы, что особенно важно при получении и анализе материалов высокой чистоты, разделении радиоизотопов, очистке биологических материалов и т. п. Реже применяют экстракцию для отделения основы от следов и, как правило, лишь в тех случаях, когда не удается выделить примесей. Макрокомпоненты экстрагируют обычно в виде комплексных металлгалогенидных кислот (например, железо из HCI-растворов диэтиловым эфиром) или коордионационно-сольватоционных солей. Микропримеси чаше экстрагируют в виде внутрикомплексных соединений, реже - в виде комплексных металлокислот. Эффективна экстракция и при разделении компонентов, обладающих близкими свойствами, в той числе высококипящих веществ и азеотропных смесей. Экстракцию широко используют для повышения чувствительности определений многими химическими и физико-химическими методами анализа. Значительную роль экстракция играет при изучении равновесий в растворах, процессов комплексообразовании и вообще при исследовании состояния веществ в растворах. Такие достоинства экстракции, как универсальность, экспрессность, простота осуществлении, быстрота, низкие рабочие температуры, доступность, отсутствие сложной аппаратуры, сравнительно небольшая (или даже отсутствие) соэкстракция, и другие, делают экстракцию весьма эффективный методом концентрирования микропримесей и разделения веществ. К настоящему времени разработаны методы экстракции почти всех элементов и многих классов соединений как для препаративных целей, так и в технологии, особенно ядерной. Экстракцию можно использовать как для абсолютного, так и для относительного концентрирования. Относительное экстракционное концентрирование, при которой достигается обогащение, т. е. уменьшается соотношение между макро- и микрокомпонентами, более важно для анализа. В практике химического анализа экстракцию применяют либо только как метод разделения; выделенный элемент при этом (при необходимости экстракт предварительно минерализуют) определяют любым обычным методом, либо в сочетании с последующим определением (экстракционно-фотометрические, экстракционно-полярографические и другие, так называемые комбинированные методы). Определение интересующего элемента можно производить как в водной, так и в органической среде Система фазДвижущая сила процессаГрадиент химического потенциалаГрадиент электрического потенциалаГрадиент давленияЖидкость-жидкость- жидкостьДиализ через жидкие мембраныЭлектродиализ через жидкие мембраны - Жидкость-твердое тело-жидкостьДиализ Электродиализ, электроосмосУльтрафильтрация, обратный осмос, пьезодиализЖидкость-твердое тело-газИспарение через мембрану - - Газ-твердое тело-газГазодиффузинное разделение - - Методы разделения, основанные на многократном равновесном распределении, всегда имеют принципиальные ограничения по чистоте выделенных фракций. Очевидно, что добиться хорошего разделения в этом случаем можно только при существенном различии в свойствах разделяемых веществ. Процесс в области этих методов всецело определяется созданием новых селективных сорбентов или экстрагентов. Но появление принципиально новых классов таких соединений, как например, фосфорорганические экстрагенты краун-эфиры или хиральные сорбенты,- явление сравнительно редкое. Как правило, поиск приводит к необходимости получения все более сложных и дорогостоящих соединений, а положительный эффект от их использования не оправдывает затраты на поиски. Отталкиваясь от приведенной в табл. 2 классификации методов, основанных на различиях в распределения веществ между фазами, можно увидеть и другой путь повышения эффективности методов этой группы, заключающийся в совершенствовании способов осуществления процессов межфазного распределения, в переходе от однократных процессов к многоступенчатым и хроматографическим. Может показаться несколько странным, что хроматографический метод отнесен к способам осуществления процесса межфазного распределения веществ. Обычно хроматографические методы рассматривают в отрыве от других методов разделения, основанных на различиях в распределении веществ между фазами. В многочисленных дефинициях хроматографии, предлагавшихся в различные годы, подчеркивается, что хроматография - это метод разделения или процесс, приводящий к разделению веществ. Здесь нет противоречий. Исторически хроматография возникла как метод разделения, суть которого сводилась к расторжению зон индивидуальных веществ при прохождении раствора, содержащего их смесь, через слой твердого сорбента. При рассмотрении физико-химических явлении, вызывающих это «расторжение», закономерно говорить о хроматографии как о процессе, происходящем в двухфазной системе. Когда же речь идет о совокупности методических приемов, применяемых практически к любой двухфазной системе, позволяющих многократноувеличить коэффициенты разделения, достигаемые при однократном равновесном распределении веществ между фазами, можно сказать, что хроматография является способом осуществления процесса межфазного разделения.. Хроматография как способ осуществления процесса межфазного заключается в относительном перемещении фаз в ограниченном пространстве в условиях, когда одна из них постоянно находится в диспергированном состоянии или в виде пленки на поверхности стенок, ограничивающих это пространство. Такое перемещение происходит в колонке, в капилляре, в тонком слое. Одна из фаз может быть неподвижной или обе будут находиться в движении. В любом случае хроматографический способ обеспечивает многократное последовательное перераспределение веществ между взаимно перемещающимися фазами, приводящее к различиям в скоростях движения зон отдельных веществ в разделительном пространстве, а в случае одновременного движения обеих фаз в различных направлениях и к различиям в направлении движении зон. И собственно методом разделения окажется приложение одного из возможных проявлений хроматографического способа осуществления процесса межфазного распределения к конкретной двухфазной системе. Предлагаемое толкование понятия «хроматография» представляется существенным для понимания общности хроматографнческих методов разделения, лежащих в основе наиболее распространенных сегодня хроматографических методов анализа. Интерес к хроматографическим методам определяется в первую очередь тем, что они теоретически не имеют ограничений по коэффициентам разделения веществ, какими бы малыми не были для них различия в коэффициентах распределения. В этом и заключается тот качественный скачок, который дает переход от методов, основанных на однократном равновесном распределении, к хроматографическим. В методах разделении веществ, основанных на различиях в межфазном распределении, всегда существуют ограничения по массопереносу. Из одной фазы в другую не может перейти вещества больше, чем это следует из коэффициента распределения, значение которого, как правило, уменьшается с ростом количества вещества в системе фаз. Переход к многоступенчатым и хроматографическим методам позволяет улучшить разделение, но вводит еще более жесткие ограничения по количеству разделяемых веществ. Так, для хроматографических методов обязательным условием становится независимость коэффициента KD от концентрации, т. е. требование линейности изотермы межфазного распределения. Отсюда для решения задач, требующих увеличения массопереноса без возрастания объема разделяющей фазы, наиболее перспективной оказывается группа методов, основанных на индуцируемом межфазном переносе вещества. Речь идет о таких процессах, в которых разделение осуществляется под воздействием постоянно действующей движущей силы.. В общем случае схема реализации таких процессов предусматривает перенос вещества на одной фазы в другую через разделяющую их третью фазу, являющуюся перегородкой, мембраной. Отсюда и название этой группы методов разделения - мембранные методы. В частном случае известны попытки осуществления индуцируемого переноса в пределах двухфазной системы - процесс электроэкстракции. Но поскольку метод не нашел широкого распространения, а его механизм описывается в рамках одной из стадий общей схемы экстракционно-мембранного процесса, он не заслуживает специального рассмотрения. Классификация по типу мембран является данью истории развития мембранных методов, т.к. их появление в большинстве случаев инициировалось созданием избирательно проницаемых материалов. Только в последние годы наметилась тенденция направленного поиска мембран, отвечающих требованиям конкретного мембранного метода разделения. Исходя из определения мембранных методов разделения как процессов индицируемого переноса вещества из одной фазы в другую через разделяющую их третью фазу, их главными классификационными признаками считают тронную систему фаз и движущую силу процесса (табл. 3). Поскольку основным преимуществом мембранной схемы осуществления процесса разделения является увеличение массопереноса вещества через разделяющую фазу, мембранные методы закономерно попадают прежде всего в сферу интересов химической технологии. Однако уже сегодня найден целый ряд интересных областей применения мембранных методов в химическом анализе, но нельзя исключить взаимнообогащающий обмен идеями между химической технологией и аналитической химией в будущем. Наконец, остается возможность разделения веществ за счет различий в свойствах их ионов, атомов или молекул, проявляемых в пределах одной гомогенной системы при воздействии электрического, магнитного, гравитационного, теплового полей или центробежных сил. При этом не исключается возможность фазовых превращений при переводе исходной смеси веществ в то агрегатное состояние, в котором происходит разделение, или при выделении фракций ее отдельных компонентов. Эффект разделения достигается за счет различного пространственного перемещения веществ в пределах фазы, в которой происходит их разделение. Различия в скорости пространственного перемещения ионов, атомов или молекул будут проявляться в зависимости от их массы, размеров, заряда, энергии взаимодействия частиц с ионами и молекулами, образующими среду, в которой происходит разделение. Относительная роль тех или иных факторов в достижении конечного эффекта разделения, в свою очередь, зависит от при природы действующих на них сил, Наиболее очевидный случай - электрофоретическое или, как его иногда называют, электромиграционное разделения ионов в растворах за счет различных скоростей их движения в электрическом воле. Здесь важнейшими факторами оказываются размеры и заряд иона. Различия в массе и заряде в наибольшей степени проявляются при воздействии на ионизованные частицы ускоряющего электрического поля и отклоняющего магнитного. Этот способ воздействия на систему лежит в основе масс-сепарационного метода. При разделении под воздействием центробежных сил - ультрацинтрифугировании определяющим фактором оказывается масса молекул.
Таблица 4. Методы внутрифазного разделения Агрегатное состояние фаз, в которой происходит разделениеВид сил, вызывающих пространственное перемещение ионов, атомов или молекулЭлектрическое полеЭлектрическое и магнитное полеЦентробежная сила или гравитационное полеЖидкость Элекрофорез (элекромиграция) - ультрацентрифугированиеГаз Электрофорез Масс-сепарацияультрацентрифугирование Следовательно, любой из известных методов внутрифазного разделения может быть охарактеризован агрегатным состоянием фазы, в пределах которой происходит разделение, и видом сил, вызывающих пространственное перемещение ионов, атомов или молекул. Для методов внутрифазного разделения в целом характерны сложные аппаратурные решения, и целесообразность их применения в аналитической химии оправдана пропорционально возможностям, которых не имеют другие методы. Самым простым по техническому оформлению является метод электрофоретического (электромиграционного) разделения ионов в растворе, сохраняющий определенные области применения в аналитической химии. Масс-сепарация как метод разделения интересна в первую очередь тем, что она является основой одного из широко распространенных методов химического анализа - масс-спектрометрии. Здесь произошло еще более тесное слияние метода разделения и методов конечного определения, чем в случае хроматографических методов анализа. При описании масс-спектромерического метода обычно даже не упоминается, что он является одним из комбинированных методов анализа. Сложность аппаратурного оформления и высокие энергозатраты в масс-сепарапионном методе компенсируются универсальностью и практически неограниченной разделительной способностью .
Общая характеристика методов концентрирования
Определение микропримесей представляет собой актуальную задачу в связи с возросшими требованиями к чистоте материалов и необходимостью аналитического контроля окружающей среды. Для определения следовых количеств пригодны только методы, позволяющие обнаружить примеси массой 10-7-10-8 г, а иногда и до 10-14 г. Наибольшее значение имеют физические методы анализа: атомно-адсобционный, нейтронно-активационный, рентгенофлуорисцентныйи некоторые другие.
Основные задачи при определении макрокомпонентов: 1.Использование очень малых навесок или объемов пробы при значительных содержаниях в них определяемых компонентов;
2.Анализ больших по массе или по объему проб для установления содержания в них следовых количеств веществ.
Для решения первой задачи помимо указанных физических методов анализа пригодны методы ультрамикроанализа, в том числе ультрамикрохимический анализ. Он представляет собой совокупность приемов использования специальной аппаратуры для работы с ультрамалыми объемами растворов. Для решения второй задачи в качестве предварительной операции используют концентрирование. Оно необходимо в тех случаях, когда нужно увеличить концентрации микрокомпонентов для последующего анализа или отделить следовые количества определяемых компонентов от основных или других микрокомпонентов. При абсолютном концентрировании микрокомпоненты переводят из большего объема в меньший. Как следует из определения, концентрирование всегда связано с разделением и перераспределением веществ по различным фазам, поэтому все методы, пригодные для разделения, используют для концентрирования. Наиболее распространенные методы перечислены в табл. 5. при выборе метода концентрирования руководствуются природой объекта и его химическим составом, последующим методом анализа, продолжительностью проведения всех операций, обеспеченностью всем необходимым оборудованием и т.п. Таблица 5. Методы концентрирования в анализе следовых количеств веществ МетодХарактеристика и преимуществаНедостатки Экстракция Позволяет концентрировать как примеси группы веществ, так и отдельные вещества. Метод универсален, прост в оформленииПрименение дорогостоящих рактивовСоосаждение Позволяет производить концентрирование веществДлителен, менее универсален, селективность малаИонообменная хроматографияИспользуется для обмена основного компонента смеси на H+(OH-) или для концентрирования микрокомпонентов из больших объемов растворов. Достигается полнота выделения при низких значениях коэффициентов распределенияСелективность мала, возможны потери и загрязнения вследствие процессов сорбции, процесс трудоемкий Отгонка Применяется для концентрирования легколетучих примесей с их конденсацией на небольшой поверхности. Не требует дополнительных реагентов и растворителейПрименение ограничено некоторыми классами веществ
Соосаждение как метод концентрирования
В последнее время особое значение для аналитических целей приобретает соосаждение - один из наиболее эффективных и давно известных методов концентрирования следовых количеств различных элементов. Соосаждение - это вид распределения» т. е. распределение микрокомпонента, вызванное выделением коллектора в твердую фазу. Другими словами, оно представляет одновременный переход микро- в макрокомпонентов в формирующуюся твердую фазу коллектора. Соосажденяе включает захват примеси при росте частиц коллектора (введенных в систему в вновь сформированных). При оствальдовой созревании осадка, а также при структурном и морфологическом совершенствовании частиц твердой фазы. В качестве коллекторов применяют гидроокиси металлов (железа, алюминия и др.), сульфиды (CdS, HgS), фосфаты (Ca3(PO4)2 и др.), сульфаты (BaSO4 и др.) и другие неорганические соединения. Различают два широких класса загрязнении: Соосаждение, когда основное вещество и примесь осаждаются вместе. Тот факт, что два вещества осаждаются одновременно, еще не говорит о соосаждении. Так, если, например, следы гидроокиси бериллия количественно осаждаются с большим количеством гидроокиси алюминия в условиях, когда оба нерастворимы, т. е. из их насыщенных растворов, то следует говорить о совместном осаждении, а не о соосаждении (сопряженном осаждении); Послеосаждение - переход примесей в осадок не во время его формирования, а после. Сначала выделяется чистый основной осадок, а потом примесь. Обычно послеосаждение происходит в пересыщенном растворе. Так, следы цинка (II), индия долгом контакте их растворов с осадком сульфидов металлов переходят в осадок. При осаждении с участием одной твердой фазы разграничивают следующие случаи соосаждения: Образование химического соединения. Валовой состав твердой фазы при этом отличен от состава каждого из ее ингредиентов, а локальный состав одинаков. Образование твердого раствора. Изменение валового состава твердой фазы при изменении концентрации компонентов в исходной смеси указывает на образование твердого раствора. Твердую фазу, возникающую при этом виде соосаждення, иногда называют соединением переменного состава. Образование твердых растворов происходит в результате молекулярных процессов, которые можно рассматривать как квазихимические реакции обмена, или присоединения. Общность молекулярного механизма образования является важным аргументом в пользу объединения всех случаев соосаждения с образованием твердых растворов в одном подклассе. Этот подкласс можно разделить на два вида в зависимости от того, кристаллический или аморфный твердый раствор. Соосаждение с образованием кристаллической твердой фазы принято называть сокристаллизацией. Образование твердой фазы с примесью, сегрегированной на дефектах. Валовой состав твердой фазы в этом случае зависит от состава исходной смеси, а локальный состав неодинаков. Выделяют два типа сегрегации: а)в объем частиц осадка при их росте переходят только макрокомпоненты исходной смеси или продукты их взаимодействия, а микрокомпонент оттесняется растущими частицами, накапливаясь вблизи границы раздела фаз (эписегрегация). Этот тип связан с захватом примеси поверхностью растущих частиц осадка;
б)микрокомпонент локализован в объеме твердой фазы (эндосегрегация), вблизи дислокаций (дислокационная эндосегрегация), на межкристаллитных границах (межкристаллитная эндосегрегация) или находится в пределах изолированных включений маточной среды(окклюзионная эндосегрегация).
В соосажденни с участием нескольких твердых фаз различают соосажденне с участием разделимых и неразделимых твердых фаз. Если процесс соосаждения протекает либо только на поверхности твердой фазы, либо также внутри нее, то выделяют два вида соосаждения: адсорбция - осаждение примеси на поверхности частиц; окклюзия - осаждение примеси внутри первичных частиц посредством любого возможного механизма. Явление соосаждения широко используют в аналитической химии как простой и эффективный способ извлечения следов элементов из сильно разбавленных растворов, в которых произведение растворимости осадка не достигается .
Заключение
Методы разделения и концентрирования привыкли рассматривать как нечто, дополняющее аналитическую химию, расширяющее ее возможности, но не как ее основополагающую основную часть. С другой стороны, как уже отмечено во введении, одно из двух основных направлений развития аналитической химии априорно ориентировано на ограниченное сочетание методов разделения и определения веществ в объектах анализа.
Список литературы
1.Москвин Л.Н., Царицина Л.Г. Методы разделения и концентрирования в аналитической химии. - Л., «Химия», 1991. - 256с.
2.Скороход О.Р. Химический анализ: Основы методов концентрирования и разделения веществ. - Мн., «Изд-во БГУ», 1980. - 272с.
.Посыпайко В.И. и др. Химические методы анализа: Учебн. пособие для хим.-технолог. вузов / Посыпайко В.И., Козырева Н.А., Логачева Ю.П. - М., «Высш. школа», 1989. - 448с.
Похожие работы на - Методы разделения и концентрирования в анализе элементов
Маскирование.
Маскирование - это торможение или полное подавление химической реакции в присутствии веществ, способных изменить ее направление или скорость. При этом не происходит образование новой фазы. Различают два вида маскирование - термодинамическое (равновесное) и кинетическое (неравновесное). При термодинамическом маскировании создаются условия, при которых условная константа реакции понижается до такой степени, что реакция идет незначительно. Концентрация маскируемого компонента становится недостаточной для того, что бы надежно зафиксировать аналитический сигнал. Кинетическое маскирование основано на увеличении разницы между скоростями реакции маскируемого и определяемого веществ с одним и тем же реагентом.
Разделение и концентрирование.
Необходимость разделения и концентрирования может быть обусловлена следующими факторами: проба содержит компоненты, мешающие определению; концентрация определяемого компонента ниже предела обнаружения метода; определяемые компоненты неравномерно распределены в пробе; отсутствуют стандартные образцы для градуировки приборов; проба высокотоксична, радиоактивна и дорога.
Разделение - это операция (процесс), в результате которой компоненты, составляющие исходную смесь, отделяются один от другого.
Концентрирование - это операция (процесс), в результате которой повышается отношение концентрации или количества микрокомпонентов к концентрации или количеству макрокомпонента.
Осаждение и соосаждение.
Осаждение, как правило, применяют для разделения неорганических веществ. Осаждение микрокомпонентов органическими реагентами, и особенно их соосаждение, обеспечивают высокий коэффициент концентрирования. Эти методы используют в комбинации с такими методами определения, которые рассчитаны на получение аналитического сигнала от твердых образцов.
Разделение путем осаждения основано на различной растворимости соединений, преимущественно в водных растворах.
Соосаждение - это распределение микрокомпонента между раствором и осадком.
Экстракция.
Экстракция - это физико-химический процесс распределения вещества между двумя фазами, чаще всего между двумя несмешивающимися жидкостями. Так же это процесс массопереноса с химическими реакциями.
Экстракционные методы пригодны для концентрирования, извлечения микрокомпонентов или макрокомпонентов, индивидуального и группового выделения компонентов при анализе разнообразных промышленных и природных объектов. Метод прост и быстр в выполнении, обеспечивает высокую эффективность разделения и концентрирования и совместим с разными методами определения. Экстракция позволяет изучать состояние веществ в растворе при различных условиях, определять физико-химические характеристики.
Сорбцию хорошо используют для разделения и концентрирования веществ. Сорбционные методы обычно обеспечивают хорошую селективность разделения, высокие значения коэффициентов концентрирования.
Сорбция - процесс поглощения газов, паров и растворенных веществ твердыми или жидкими поглотителями на твердом носителе (сорбентами).
Электролитическое выделение и цементация.
Наиболее распространен метод электоровыделения, при котором отделяемое или концентрированное вещество выделяют на твердых электродах в элементарном состоянии или в виде какого-то соединения. Электролитическое выделение (электролиз) основано на осаждении вещества электрическим током при контролируемом потенциале. Наиболее распространен вариант катодного осаждения металлов. Материалом электродов может служить углерод, платина, серебро, медь вольфрам и т.д.
Электрофорез основан на различиях в скоростях движения частиц разного заряда, формы и размера в электрическом поле. Скорость движения зависит от заряда, напряженности поля и радиуса частиц. Различают два варианта электрофореза: фронтальный (простой) и зонный (на носителе). В первом случае небольшой объем раствора, содержащего разделяемые компоненты, помещают в трубку с раствором электролита. Во втором случае передвижение происходит в стабилизирующей среде, которая удерживает частицы на местах после отключения электрического поля.
Метод цементации заключается в восстановлении компонентов (обычно малых количеств) на металлах с достаточно отрицательными потенциалами или альмагамах электроотрицательных металлов. При цементации происходит одновременно два процесса: катодный (выделение компонента) и анодный (растворение цементирующего металла).
Методы испарения.
Методы дистилляции основаны на разной летучести веществ. Вещество переходит из жидкого состояния в газообразное, а затем конденсируется, образуя снова жидкую или иногда твердую фазу.
Простая отгонка (выпаривание) - одноступенчатый процесс разделения и концентрирования. При выпаривании удаляются вещества, которые находятся в форме готовых летучих соединений. Это могут быть макрокомпоненты и микрокомпоненты, отгонку последних применяют реже.
Возгонка (сублимация) - перевод вещества из твердого состояния в газообразное и последующее осаждение его в твердой форме (минуя жидкую фазу). К разделению возгонкой прибегают, как правило, если разделяемые компоненты трудно плавятся или трудно растворимы.
Управляемая кристаллизация.
При охлаждении раствора, расплава или газа происходит образование зародышей твердой фазы - кристаллизация, которая может быть неуправляемой (объемной) и управляемой. При неуправляемой кристаллизации кристаллы возникают самопроизвольно во всем объеме. При управляемой кристаллизации процесс задается внешними условиями (температура, направление движения фаз и т.п.).
Различают два вида управляемой кристаллизации: направленную кристаллизацию (в заданном направлении) и зонную плавку (перемещение зоны жидкости в твердом теле в определенном направлении).
При направленной кристаллизации возникает одна граница раздела между твердым телом и жидкостью - фронт кристаллизации. В зонной плавке две границы: фронт кристаллизации и фронт плавления.
36.Методы разделения веществ в аналитической химии.
Разделение – это операция (процесс), в результате которого компоненты , составляющие исходную смесь, отделяются один от другого. Наибольшее распространение получили следующие методы предварительного концентрирования и разделения.
Физические:
Методы испарения
Плавление и кристаллизация (замерзание
Озоление – сухом озолении влажном (мокром) озолении Флотация
Химические:
Осаждение и соосаждение центрифугирование.
Комплексообразование.
Физико-химические:
Хроматографические методы
Сорбционные методы адсорбцию (поглощение поверхностью), абсорбцию (поглощение объемом), хемосорбцию
Электрофоретические методы –
Экстракция -
2.3. Осаждение и соосаждение
Соосаждение коллекторо м (или носителем микрокомпонентов ). В отсутствие коллектора микрокомпонент не образует осадок, так как произведение растворимости соответствующих соединений , содержащих микрокомпоненнт, не достигается.В аналитической практике используются как неорганические (гидроксиды алюминия и железа, фосфат железа), так и органические соосадители (малорастворимые соединения ионов органических веществ, например метилового фиолетового, метилового оранжевого, нафталина, α -сульфокислоты, диметиламиноазобензола). Предпочтение отдается органическим соосадителям, которые позволяют выделять определяемые ионы из растворов с концентрацией до 1: 10 13 и отличаются высокой селективностью. Кроме того, органические соосадители легко озоляются, благодаря чему соосаждаемые элементы удается получить в чистом виде.
37. Методы концентрации веществ в аналитической химии. Концентрирование – операция (процесс), в результате которого повышается отношение концентрации или количества микрокомпонентов к концентрации или количеству макрокомпонентов, или основы (матрицы).
Необходимость разделения и концентрирования может быть обусловлена следующими факторами:
проба содержит компоненты, мешающие определению;
концентрация определяемого компонента ниже предела обнаружения метода;
определяемые компоненты неравномерно распределены в пробе;
отсутствуют стандартные образцы для градуировки приборов;
проба высокотоксична, радиоактивна или дорога.
Абсолютное концентрирование – это перевод микрокомпонентов из большой массы (или большого объема) образца в малую массу (или малый объем). При этом повышается концентрация микрокомпонентов.
Относительное концентрирование (обогащение)– это увеличение отношения между количествами микро- и макрокомпонентов (отделение определяемых микрокомпонентов от основы , от мешающих микрокомпонентов).
Результаты концентрирования количественно характеризуют коэффициентом (фактором) концентрирования F (встречаются и другие обозначения):
где и - соответственно количество (или концентрация) микрокомпонента и макрокомпонента до концентрирования; и - соответственно количество (или концентрация) микрокомпонента и макрокомпонента после концентрирования. В случае абсолютного концентрирования и - количество (объем) раствора до и после концентрирования.
Наибольшее распространение получили следующие методы предварительного концентрирования и разделения.
Физические:
Методы испарения (упаривание, перегонка, сублимация); отгонки (широко используют для удаления летучих веществ, например, солей аммония) - разделение основано на разной летучести компонентов.
Плавление и кристаллизация (замерзание ) - разделение основано на преимущественном переходе одного из компонентов раствора или расплава в твердую фазу (напр., метод зонной плавки, применяющийся для концентрирования примесных веществ).
Озоление – метод, при котором исходный анализируемый материал путем термической обработки на воздухе превращают в минеральный остаток – золу (часто применяют при анализе лекарственного сырья). При сухом озолении образец медленно нагревают и после удаления продуктов сгорания прокаливают при температуре красного каления (≈ 500 С о) до постоянной массы; при влажном (мокром) озолении образец обрабатывают раствором соответствующего реактива (например, смачивают конц. серной к-той), медленно нагревают и после удаления продуктов сгорания прокаливают при температуре красного каления до постоянной массы.
Флотация - разделение основано на различии плотностей основного вещества и примесей (применяют для отделения пустой породы).
Химические:
Осаждение и соосаждение - один из наиболее простых и эффективных способов концентрирования ионов (подробно будет рассмотрен далее). Для отделения осадка широко используют центрифугирование.
Комплексообразование.
Физико-химические:
Хроматографические методы - совокупность различных методов, основанных на различии в сродстве разделяемых компонентов, перемещаюшихся с подвижной фазой (жидкость, газ) к неподвижной фазе (твердое вещество, ваязкая жидкость). Например, при ионообменной хроматографии разделение основано на различиях в сорбируемости компонентов.
Сорбционные методы – основаны на использовании различий в способности разделяемых или концентрируемых компонентов поглощаться веществами-носителями (сорбентами). Различают адсорбцию (поглощение поверхностью), абсорбцию (поглощение объемом), хемосорбцию (поглощение, сопровождающееся протеканием химических реакций).
Электрофоретические методы – основаны на использовании различий в скоростях движения заряженных частиц растворенных веществ во внешнем электрическом поле. Эффективен при разделении как низкомолекулярных, так и высокомолекулярных веществ, например, смеси белков, аминокислот и др.
Экстракция - совокупность методов, основаных на использовании различий в растворимости извлекаемого компонента в двух контактирующих несмешивающихся фазах (двух жидких или жидкой и твердой).
Например, дитизон, купферон и другие органические соединения с некоторыми ионами металлов образуют комплексы, легко экстрагируемые из водных растворов эфиром или хлороформом.
2.3. Осаждение и соосаждение
Соосаждение – одновременное осаждение обычно растворимого микрокомпонента с выпадающим в осадок макрокомпонентом из одного и того же раствора вследствие образования смешанных кристаллов, адсорбции, окклюзии и т.д. Осадок макрокомпонента называют коллекторо м (или носителем микрокомпонентов ).
В отсутствие коллектора микрокомпонент не образует осадок, так как произведение растворимости соответствующих соединений, содержащих микрокомпоненнт, не достигается.
В аналитической практике используются как неорганические (гидроксиды алюминия и железа, фосфат железа), так и органические соосадители (малорастворимые соединения ионов органических веществ, например метилового фиолетового, метилового оранжевого, нафталина, α -сульфокислоты, диметиламиноазобензола). Предпочтение отдается органическим соосадителям, которые позволяют выделять определяемые ионы из растворов с концентрацией до 1: 10 13 и отличаются высокой селективностью. Кроме того, органические соосадители легко озоляются, благодаря чему соосаждаемые элементы удается получить в чистом виде.
38. Экстракционное равновесие. Закон распределения Нернста-Шилова.
Экстракция - совокупность методов, основаных на использовании различий в растворимости извлекаемого компонента в двух контактирующих несмешивающихся фазах (двух жидких или жидкой и твердой). В большинстве случаев в аналитической химии используют комбинацию двух контактирующих несмешивающихся фаз «органический растворитель – водный раствор разделяемых (извлекаемых) веществ». В таком случае говорят о жидкостной экстракции. Для экстрагирования подбирают такой органический растворитель, в котором определяемое вещество растворяется хорошо, а другие компоненты смеси практически не растворяются. Достоинства экстракционных методов:
простота
доступность
избирательность
возможность работать как с большими, так и с малыми концентрациями
быстрота проведения
дешевизна оборудования и т.д.
где а(орг) и а(водн) - равновесные активности вещества А в органической и водной фазе соответственно. Величина Р в данном случае называется константой распределения (истинная термодинамическая), она постоянна при постоянной температуре для данной системы.
Учитывая, что активность равна произведению коэффициента активности на концентрацию
Р Р , тем полнее органическое вещество извлекается из водного раствора в органическую фазу.
Из этих уравнений следует, что методом экстракции нельзя в равновесных условиях абсолютно полностью выделить вещество из водной фазы в органическую, поскольку равновесная концентрация вещества в водной фазе отлична от 0.
39. Экстракционное равновесие. Константа распределения, коэффициент распределения. Степень извлечения. Фактор разделения двух веществ. Условия разделения двух веществ.
Рассмотрим распределение вешества А между двумя контактирующими несмешивающимися жидкими органической и водной фазами при постоянной температуре: А(водн) ↔ А(орг). Это равновесие будет характеризоваться константой равновесия Р, равной
где а(орг) и а(водн) - равновесные активности вещества А в органической и водной фазе соответственно. Величина Р в данном случае называется константой распределения (истинная термодинамическая), она постоянна при постоянной температуре для данной системы.Учитывая, что активность равна произведению коэффициента активности на концентрацию
Если химическая природа вещества А одинакова в обеих жидких фазах и
Эти формулы отражают закон распределения Нернста. Константа Р зависит от природы распределяемого вещества и жидких фаз и температуры. Чем больше Р , тем полнее органическое вещество извлекается из водного раствора в органическую фазу. Из этих уравнений следует, что методом экстракции нельзя в равновесных условиях абсолютно полностью выделить вещество из водной фазы в органическую, поскольку равновесная концентрация вещества в водной фазе отлична от 0.
Многие вещества часто находятся в несмешивающихся контактирующих жидких органической и водной фазах в неодинаковой химической форме. Например, слабые органические кислоты в водном растворе частично находятся в ионизированной форме, т.е. в водном растворе существует две формы – молекулы и анионы слабой кислоты. В органической фазе возможна димеризация молекул кислоты за счет образования водородных связей, т.е. в органической фазе присутствуют две химические формы кислоты – мономер и димер. В подобных случаях (а они встречаются очень часто) суммарное существование различных форм распределяемого вещества учитывается введением коэффициента распределения D (встречаются и иные буквенные обозначения коэффициента распределения):
где - сумма равновесных концентраций в органической исходной концентрации экстрагируемого вещества . Это одно из важных достоинств экстракционного метода, благодаря которому он в равной мере применим как к следовым содержаниям веществ, так и к высоким концентрациям.
Под степенью извлеченияR
понимают выраженное в процентах отношение суммарной массы (суммарного количества) экстрагируемого вещества в органической фазе к его общей массе (суммарному количеству) в обеих фазах:![]() S
(А/В) = 1 разделение двух веществ А и В невозможно. Разделение возможно, если соблюдаются следующие два условия:
S
(А/В) = 1 разделение двух веществ А и В невозможно. Разделение возможно, если соблюдаются следующие два условия:
S (А/В) ≥ 10 4 и D (А)D (В) ≤ 1. Константа экстракции К экс ,
Прямые инструментальные методы часто не могут быть использованы при анализе многих сложных объектов либо вследствие негомогенного распределения компонентов в образце, либо в связи с трудностями градуировки, когда отсутствуют стандартные образцы известного состава. Это может быть справедливо в отношении целого ряда промышленных, геологических, биологических материалов, объектов окружающей среды, а также веществ высокой чистоты, содержащих некоторые компоненты на уровне мкг/л, нг/г, нг/л. В таких случаях прибегают к концентрированию и разделению микрокомпонентов, отделению основной массы макрокомпонентов либо элементов-примесей с последующим анализом полученного концентрата различными химическими и инструментальными методами.
В основе операций разделения и концентрирования лежат одни и те же процессы и методы, основанные на различии химических и физических свойств разделяемых компонентов - растворимости, сорбции, температур кипения и сублимации и, отличающиеся концентрациями разделяемых компонентов.
Разделение - это процесс или операция, в результате которого компоненты, составляющие исходную смесь, и концентрации которых могут быть соизмеримы, отделяются друг от друга.
Концентрирование - это процесс или операция, в результате которых повышается отношение концентраций или количества микрокомпонентов к концентрации или количеству макрокомпонентов.
Экстракция - метод разделения и концентрирования, основанный на распределения растворенного вещества между двумя несмешивающимися фазами (обычно на практике одной фазой является водный раствор, а второй - органический растворитель). Основные преимущества экстракционного метода:
1) возможность варьирования избирательности разделения
2) возможность работы с аналитами на различных уровнях концентраций;
3) легкость технологического и аппаратурного оформления;
4) возможность осуществления непрерывного процесса, автоматизации;
5) высокая производительность.
Экстракционные методы выделения веществ нашли широкое применение при анализе компонентов некоторых промышленных и природных объектов. Экстракция выполняется достаточно быстро, при этом достигается высокая эффективность разделения и концентрирования, легко совместима с разнообразными методами анализа. Многие аналитически методы экстракции стали прообразами важных технологических экстракционных процессов, особенно в атомной энергетике.
Основные термины метода экстракции:
экстрагент - органический растворитель, содержащий или не содержащий другие компоненты и экстрагирующий вещество из водной фазы;
экстракционный компонент - реагент, образующий с извлекаемым компонентом комплекс или соль, которые способны экстрагироваться;
разбавитель - инертный (органический) растворитель, используемый для улучшения физических (плотность, вязкость и др.) или экстракционных (например, избирательность) свойств экстрагента. Под инертностью понимается неспособность образовывать соединения с извлекаемым веществом.
экстракт - отделенная органическая фаза, содержащая экстрагированное из водной фазы вещество;
реэкстракция - процесс обратного извлечения вещества из экстракта в водную фазу;
реэкстрагент - раствор (обычно водный или только вода) используемый для извлечения вещества из экстракта;
реэкстракт - отделенная фаза (обычно водная), содержащая вещество, извлеченное из экстракта в результате реэкстракции;
высаливание - улучшение экстракции вещества путем добавления электролита (высаливателя), который способствует образованию экстрагируемого соединения в водной фазе.
Типы экстракционных систем
При осуществлении жидкость-жидкостной экстракции можно выделить несколько типов экстракционных систем.
Экстракционные системы I типа. В этих экстракционных системах в качестве органической фазы используются органические растворители или их смеси, а в качестве водной фазы либо вода, либо водные растворы солей. Большое распространение таких экстракционных систем объясняется дешевизной воды как растворителя, ее ограниченной смешиваемостью со многими органическими растворителями, а также тем, что в подавляющем большинстве случаев объект, который необходимо экстрагировать, либо изначально находится в водном растворе, либо переводится в водорастворимое состояние в процессе пробоподготовки объекта.
В ряде случаев, экстракционные системы I типа непригодны для работы, в этом случае используют экстракционные системы II типа.
Экстракционные системы II типа. В этих экстракционных системах в качестве неполярной фазы используется алифатический углеводород, второй же фазой служит либо полярный органический растворитель, либо его водный раствор, либо раствор галогенида цинка в полярном органическом растворителе. Как правило, в качестве алифатического углеводорода чаще всего используют легкокипящие углеводороды, в частности гексан, гептан, октан, циклогексан или петролейный эфир.
Важным критерием выбора растворителей экстракционной системы является ограниченная смешиваемость экстракционных фаз.
Способы осуществления экстракции
В зависимости от решаемой задачи применяют простую экстракцию, периодическую экстракцию или противоточную экстракцию. Периодическая экстракция представляет собой экстракцию вещества из одной фазы отдельными порциями свежего экстрагента. При остаточно высоких значениях коэффициента распределения однократная экстракция позволит количественно извлечь вещество в органическую фазу. Эффективность однократной экстракции можно характеризовать степенью извлечения -R, %, рассчитываемой по формуле: $R=орг*100%/общ$ где орг. - количество вещества А в органической фазе; общ - общее количества вещества А в обеих фазах.
Если однократная экстракция не обеспечивает достаточной степени извлечения, то R можно повысить за счет увеличения объема органической фазы или прибегая к многократной экстракции.
Периодическую экстракцию преимущественно проводят в делительной воронке, в которую вводят водный раствор, содержащий экстрагируемое соединение, и органический растворитель, не смешивающийся с водной фазой. Затем воронку энергично встряхивают для обеспечивания контакта фаз. После встряхивания фазы разделяют.
Серьезным недостатком многократной экстракции является значительное разбавление извлекаемого компонента, особенно если число стадий велико. Расход экстрагента можно уменьшить, если исчерпывающую экстракцию проводить в аппаратах для непрерывной экстракции. Непрерывная экстракци осуществляется при непрерывном и относительном перемещении двух фаз; одна из фаз, обычно водная, остаѐтся неподвижной.
Непрерывная экстракция особенно удобна, когда коэффициент распределения очень мал и для количественного извлечения было бы необходимо провести очень большое число последовательных экстракций. Общий принцип непрерывной экстракции заключается в дистилляции экстрагента из перегонной колбы, конденсировании и пропускании его через раствор, подвергаемый экстракции. Экстрагент отделяется и стекает обратно в приемную колбу, откуда он снова отгоняется и заново проходит цикл, в то время как экстрагируемое вещество остается в приемной колбе. В том случае, если растворитель нельзя легко перегнать, порции свежего растворителя могут непрерывно добавляться из резервуара, но при этом расход экстрагента будет значительным.
Противоточную экстракцию проводят в аппарате Крейга, который состоит из ряда ячеек специальной конструкции, устроенных таким образом, что одна фаза (например, органическая) последовательно переходит из одной ячейки в другую после каждого равновесного распределения.
Схематическое изображение прибора для противоточной экстракции
Перед началом экстракции все ячейки частично заполняют тяжелым растворителем, который является неподвижной фазой. В ячейку 0 помещают разделяемую смесь в том же растворителе. Затем в ячейку 0 вводят более легкий несмешивающийся с первым растворитель (подвижная фаза). Фазы перемешивают и оставляют расслаиваться. После расслоения фаз верхний слой из ячейки 0 переносят в ячейку 1, а в ячейку 0 вводят новую порцию свежего растворителя и проводят одновременную экстракцию в обеих ячейках. Далее верхние слои из ячеек 0 и 1 переносят в ячейки 1 и 2 соответственно, в ячейку 0 снова вводят новую порцию подвижной фазы и процесс экстракции повторяют. Введение в систему свежего растворителя позволяет осуществить любое число экстракций.
Противоточная экстракция обладает большой эффективностью разделения. С ее помощью удается разделить вещества с близкими химическими свойствами. Например, этот метод применяли для разделения редкоземельных элементов. Противоточное разделение широко применяют для фракционирования органических соединений. Существенным недостатком противоточной экстракции является сильное разбавление компонентов при разделении.