Ароматические углеводороды виды изомерии. Арены
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода вих молекулах.
Физические свойства некоторых аренов представлены в таблице.
Таблица. Физические свойства некоторых аренов
|
Название |
Формула |
t°.пл., |
t°.кип., |
|
Бензол |
C 6 H 6 |
5,5 |
80,1 |
|
Толуол (метилбензол) |
С 6 Н 5 СH 3 |
95,0 |
110,6 |
|
Этилбензол |
С 6 Н 5 С 2 H 5 |
95,0 |
136,2 |
|
Ксилол (диметилбензол) |
С 6 Н 4 (СH 3) 2 |
||
|
орто- |
25,18 |
144,41 |
|
|
мета- |
47,87 |
139,10 |
|
|
пара- |
13,26 |
138,35 |
|
|
Пропилбензол |
С 6 Н 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Кумол (изопропилбензол) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
Стирол (винилбензол) |
С 6 Н 5 CH=СН 2 |
30,6 |
145,2 |
Бензол – легкокипящая ( t кип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для жизни, токсичны.
Получение аренов (бензола и его гомологов)
В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
бензоат натрия
2. Реакция Вюрца-Фиттинга : (здесь Г – галоген)
С 6 H 5 -Г + 2 Na + R -Г → C 6 H 5 - R + 2 Na Г
С 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:
C 6 H 14 t , kat →C 6 H 6 + 4H 2
2. Тримеризация ацетилена (только для бензола) – р. Зелинского :
3С 2 H 2 600° C , акт. уголь →C 6 H 6
3. Дегидрированием циклогексана и его гомологов:
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов
C 6 H 12 t, kat →C 6 H 6 + 3H 2

C 6 H 11 -CH 3 t , kat →C 6 H 5 -CH 3 + 3H 2
метилциклогексантолуол
4. Алкилирование бензола (получение гомологов бензола) – р Фриделя-Крафтса .
C 6 H 6 + C 2 H 5 -Cl t, AlCl3 →C 6 H 5 -C 2 H 5 + HCl
хлорэтан этилбензол

Химические свойства аренов
I . РЕАКЦИИ ОКИСЛЕНИЯ
1. Горение (коптящее пламя):
2C 6 H 6 + 15O 2 t →12CO 2 + 6H 2 O + Q
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
А) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Упрощённо:
C 6 H 5 -CH 3 + 3O KMnO4 →C 6 H 5 COOH + H 2 O
Б) в нейтральной и слабощелочной до солей бензойной кислоты
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO К + K ОН + 2MnO 2 + H 2 O
II . РЕАКЦИИ ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
1. Галогенирование
C 6 H 6 +3Cl 2 h ν → C 6 H 6 Cl 6 (гексахлорциклогексан - гексахлоран)
2. Гидрирование
C 6 H 6 + 3H 2 t , Pt или Ni →C 6 H 12 (циклогексан)
3. Полимеризация
III . РЕАКЦИИ ЗАМЕЩЕНИЯ – ионный механизм(легче, чем у алканов)
б) гомологов бензола при облучении или нагревании
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
1) C 6 H 5 -CH 3 + Cl 2 h ν → C 6 H 5 -CH 2 -Cl + HCl
в) гомологов бензола в присутствии катализатора
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (смесь орта, пара производных) +HCl
2. Нитрование (с азотной кислотой)
C 6 H 6 + HO-NO 2 t, H2SO4 →C 6 H 5 -NO 2 + H 2 O
нитробензол - запах миндаля !
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4 → С H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-тринитротолуол (тол, тротил)
Применение бензола и его гомологов
Бензол C 6 H 6 – хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива. Служит сырьем для получения многих ароматических органических соединений – нитробензола C 6 H 5 NO 2 (растворитель, из него получают анилин), хлорбензола C 6 H 5 Cl, фенола C 6 H 5 OH, стирола и т.д.
Толуол C 6 H 5 –CH 3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C 6 H 4 (CH 3) 2 . Технический ксилол – смесь трех изомеров (орто -, мета - и пара -ксилолов) – применяется в качестве растворителя и исходного продукта для синтеза многих органических соединений.
Изопропилбензол C 6 H 5 –CH(CH 3) 2 служит для получения фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения в бензоле атомов Н атомами хлора – гексахлорбензол С 6 Сl 6 – фунгицид; его применяют для сухого протравливания семян пшеницы и ржи против твердой головни. Продукт присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С 6 Н 6 Сl 6 – инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые вещества относятся к пестицидам – химическим средствам борьбы с микроорганизмами, растениями и животными.
Стирол C 6 H 5 – CH = CH 2 очень легко полимеризуется, образуя полистирол, а сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
ВИДЕО-ОПЫТЫ
Ароматические углеводороды (арены) - углеводороды, в молекулах которых есть одно или несколько бензольных колец. Состав аренов с одним бензольным кольцом отвечает общей формуле C n H 2n-6 .
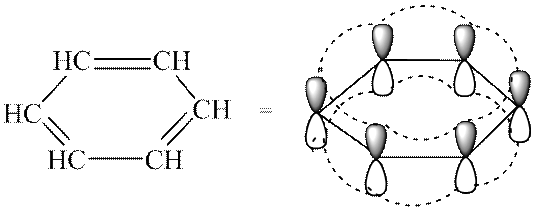
В молекуле простейшего арена - бензола (C 6 H 6) - -связи образуют единую делокализованную сопряженную (ароматическую) систему -связей.
Строение молекулы простейшего арена - бензола - может быть передано структурными формулами различных типов:
Изомеры и гомологи
| г | бензол |
|||||
метилбензол (толуол) |
||||||
этилбензол |
1,2-диметилбензол (орто -ксилол) |
1,3-диметилбензол (мета -ксилол) |
1,4-диметилбензол (пара -ксилол) |
|||
пропилбензол |
изопропилбензол |
1,2,4-три-метилбензол |
1-метил-2-этилбензол |
1-метил-3-этилбензол |
1-метил-4-этилбензол |
|
| и з о м е р ы | ||||||
Основой названия замещенного производного бензола является слово "бензол". Атомы в бензольном кольце нумеруются, начиная от старшего заместителя к младшему. Пример: 1-метил-2-этилбензол, а не 1-этил-2-метилбензол. Если заместители одинаковы, то нумерацию проводят по самому краткому пути. Пример: 1,3-диметилбензол, а не 1,5-диметилбензол.
Приставки орто- , мета- , пара- (от греческого ортос - прямой, мета - после, через, между, пара - против, возле, мимо) в названиях органических веществ (сокращенно: о- , м- , п- ) используются для указания взаимного расположения двух заместителей в бензольном кольце.
Физические свойства бензола: бесцветная нерастворимая в воде жидкость со своеобразным запахом, температура плавления 5,4 o С, температура кипения 80,1 o С, плотность 0,88 г/см 3 . Пары бензола ядовиты.
Бензол не обесцвечивает при обычных условиях бромную воду и раствор перманганата калия.
Получение аренов
Задачи и тесты по теме "Тема 3. "Ароматические углеводороды"."
- Углеводороды. Полимеры - Органические вещества 8–9 класс
Уроков: 7 Заданий: 9 Тестов: 1
- - Человек в мире веществ, материалов и химических реакций 8–9 класс
Уроков: 2 Заданий: 6 Тестов: 1
- Классификация веществ - Классы неорганических веществ 8–9 класс
Уроков: 2 Заданий: 9 Тестов: 1
- Кристаллические решётки - Строение вещества 8–9 класс
Уроков: 1 Заданий: 9 Тестов: 1
- Состав растворов - Растворы 8–9 класс
Уроков: 3 Заданий: 8 Тестов: 1
Изучив тему, Вы должны: усвоить понятия ароматические углеводороды, ароматическая связь, знать общую формулу аренов, номенклатурные правила, типы реакций замещения (галогенирование в присутствии катализатора, нитрование), присоединения (галогенирование на свету, гидрирование).
Проверьте, умеете ли Вы производить расчеты по уравнениям реакций и выводить молекулярные формулы веществ по массовым долям элементов, находит выход продукта реакции и решать задачи с учетом массовой доли примеси.
Пример 1. Углеводород, плотность паров которого по водороду равна 15, содержит 80 % углерода. Найдите его молекулярную формулу.
Ответ: C 2 H 6
Пример 2. Из 7,8 г бензола получено 8,61 г нитробензола. Определите выход продукта реакции.
Ответ: 70%
Пример 3. Технический карбид кальция массой 20 г обработали избытком воды. Какой объем ацетилена получили, если массовая доля примесей техническом карбиде составляла 20 %.
Ответ: 5,6 л
Убедившись, что все необходимое усвоено, переходите к выполнению заданий к теме. Желаем успехов.
Рекомендованная литература:
- О. С. Габриелян и др. Химия 10 кл. М., Дрофа, 2002;
- Л. С. Гузей, Р. П. Суровцева, Г. Г. Лысова. Химия 11 кл. Дрофа, 1999.
- Г. Г. Лысова. Опорные конспекты и тесты по органической химии. М., ООО "Глик плюс", 1999.
А РЕНЫ
Ароматические углеводороды (арены) – циклические углеводороды, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Классификация
По числу бензольных колец в молекуле арены подразделяются на:
моноядерные
многоядерные

Номенклатура и изомерия
Структурным родоначальником углеводородов бензольного ряда служит бензол С 6 Н 6 от которого строятся систематические названия гомологов.
Для моноциклических соединений сохраняются следующие несистематические (тривиальные) названия:

Положение заместителей указывают наименьшими цифрами (направление нумерации не имеет значения),
|
|
|
а для ди замещенных соединений можно использовать обозначения орто, мета , пара.
|
|
|
|
Если в кольце три заместителя тони должны получить наименьшие номера, т.е. ряд «1,2,4» имеет преимущество перед «1,3,4».


1,2-диметил-4-этилбензол (верное название) 3,4-диметил-1-этилбензол (неверно)
Изомерия монозамещенных аренов обусловлена строением углеродного скелета заместителя, у ди- и полизамещенных гомологов бензола добавляется ещё изомерия, вызванная различным расположением заместителей в ядре.
Изомерия ароматических УВ состава С 9 Н 12:
|
|
|
|
|
Физические свойства
Температуры кипения и плавления у аренов выше, чем у алканов, алкенов, алкинов, малополярные, не растворимы в воде и хорошо растворимы в неполярных органических растворителях. Арены это жидкости или твердые вещества, имеющие специфические запахи. Бензолы и многие конденсированные арены токсичны, некоторые из них проявляют концерогенные свойства. Промежуточными продуктами окисления конденсированных аренов в организме являются эпоксиды, которые либо сами непосредственно вызывают рак, либо являются предшественниками канцерогенов.
Получение аренов
Многие ароматические УВ имеют важное практическое значение и производятся в крупном промышленном масштабе. Ряд промышленных способов основан на переработке угля и нефти.
Нефть состоит главным образом из алифатических и алициклических УВ, для превращения алифатических или ациклических УВ в ароматические разработаны способы ароматизации нефти, химические основы которых развиты Н.Д. Зелинским, Б.А. Казанским.
1. Циклизация и дегидрирование:
2. Гидродезметилирование:

3. Гомологи бензола получают путем алкилирования или ацилирования с последующим восстановлением карбонильной группы.
а) Алкилирование по Фриделю-Крафтсу:

б) Ацилирование по Фриделю-Крафтсу:

4. Получение бифенила по реакции Вюрца-Фитинга:
5. Получение дифенилметана по реакции Фриделя-Крафтса:
Строение и химические свойства.
Критерии ароматичности:
На основании теоретических расчетов и экспериментального изучения циклических сопряженных систем было установлено, что соединение ароматично, если оно имеет:
- Плоский циклический σ-скелет;
- Сопряженную замкнутую π-электронную систему, охватывающую все атомы цикла и содержащую 4n + 2, где n = 0, 1, 2, 3 и т.д. Эта формулировка известна, как правило Хюккеля. Критерии ароматичности позволяют отличать сопряженные ароматические системы от всех других. Бензол содержит секстет π-электронов и соответствует правилу Хюккеля при n = 1.
Что дает ароматичность:
Несмотря на высокую степень ненасыщенности, ароматические соединения устойчивы к действию окислителей и температуры, они более склонны вступать в реакции замещения, а не присоединения. Эти соединения обладают повышенной термодинамической стабильностью, обеспечивающейся высокой энергией сопряжения ароматической системы кольца (150 кДж/моль), поэтому арены предпочтительней вступают в реакции замещения, в результате чего сохраняют ароматичность.
Механизм реакций электрофильного замещения в ароматическом кольце:
Электронная плотность π-сопряженной системы бензольного кольца является удобным объектом для атаки электрофильными реагентами.
Как правило, электрофильные реагенты генерируются в процессе реакции при помощи катализаторов и соответствующих условий.
Е – Y → E δ + – Y δ - → E + + Y -
Образование π-комплекса. Первоначальная атака электрофилом π-электронного облака кольца приводит к координации реагента с π-системой и образованию комплекса донорно-акцепторного типа называемого π-комплекса. Ароматическая система не нарушается:

Образование σ-комплекса. Лимитирующая стадия, на ней электрофил образует ковалентную связь с атомом углерода за счет двух электронов π-системы кольца, что сопровождается переходом данного атома углерода из sp 2 - в sp 3 - гибридное состояние и нарушением ароматической, молекула превращается в карбокатион.

Стабилизация σ-комплекса. Осуществляется путем отщепления от σ-комплекса протона с помощью основания. При этом за счет двух электронов разрывающейся ковалентной связи С – Н восстанавливается замкнутая π-системы кольца, т.е. происходит возврат молекулы в ароматическое состояние:

Влияние заместителей на реакционную способность и ориентацию электрофильного замещения
Заместители в бензольном кольце нарушают равномерность в распределении π- электронного облака кольца и тем самым оказывают влияние на реакционную способность кольца.
- Электронодонорные заместители (Д) повышают электронную плотность кольца и увеличивают скорость электрофильного замещения, такие заместители называют активирующими.
- Электроноакцепторные заместители (А) понижают электронную плотность кольца и уменьшают скорость реакции, называются дезактивирующими.
1. Классификация ароматических углеводородов.
2. Гомологический ряд моноциклических аренов, номенклатура, получение.
3. Изомерия, строение бензола и его гомологов.
4. Свойства аренов.
Аренами называют богатые углеродом циклические углеводороды, которые содержат в молекуле бензольное ядро и обладают особыми физическими и химическими свойствами. Арены по числу бензольных колец в молекуле и способа соединения циклов подразделяют на моноциклические (бензол и его гомологи) и полициклические (с конденсированными и изолированными циклами) соединения.
Арены бензольного ряда можно рассматривать как продукты замещения атомов водорода в молекуле бензола на алкильные радикалы. Общая формула таких аренов СnH 2 n- 6. В названии монозамещенных аренов указывают название радикала и цикла (бензол):
бензол метилбензол (толуол) этилбензол.
В более замещенных аренах положение радикалов указывают наименьшими цифрами, в дизамещенных аренах положение радикалов называют: 1,2 - орто (o -)-, 1,3 - мета (м -)- и 1,4 - пара (п -)-:

1,3-диметилбензол 1,2-метилэтилбензол
м -диметилбензол (м -ксилол) о -метилэтилбензол (о -ксилол)
Для аренов широко распространены тривиальные названия (некоторые названия указаны в скобках).
Нахождение в природе.
Ароматические углеводороды встречаются в растительных смолах и бальзамах. Фенантрен в частично или полностью гидрированном виде содержится в структурах многих природных соединений, например стероидов, алкалоидов.
Получение аренов:
1. сухая перегонка каменного угля;
2. дегидрирование циклоалканов

3. дегидроциклизация алканов с 6 и более атомами углерода в составе
4. алкилирование

![]()
Изомерия. Для гомологов бензола характерна структурная изомерия: различное строение углеродного скелета бокового радикала и различные состав и расположение радикалов в бензольном кольце. Например, изомеры ароматических углеводородов состава С 9 Н 12 (пропилбензол, изопропилбензол, о-метилэтилбензол и 1,2,4-триметилбензол):
Строение. Ароматические углеводороды имеют целый ряд особенностей в электронном строении молекул.
Структурную формулу бензола впервые предложил А. Кекуле. Это шестичленный цикл с чередующимися двойными и одинарными связями, при этом двойные связи перемещаются в структуре:
![]()
В обеих формулах углерод четырехвалентен, все атомы углерода равноценны и дизамещенные бензола существуют в виде трех изомеров (орто -, мета -, пара- ). Однако такая структура бензола противоречила его свойствам: бензол не вступал в характерные для непредельных углеводородов реакции присоединения (например, брома) и окисления (например, с перманганатом калия), для него и его гомологов основной тип химического превращения - реакции замещения.
Современный подход к описанию электронного строения бензола разрешает это противоречие следующим образом. Атомы углерода в молекуле бензола находятся в sр 2 -гибридизации. Каждый из атомов углерода образует три ковалентные σ-связи - 2 связи с соседними атомами углерода (sр 2 -sр 2 -перекрывание орбиталей) и одну с атомом водорода (sр 2 -s- перекрывание орбиталей). Негибридизованные р-орбитали за счет бокового перекрывания образуют π-электронную сопряженную систему (π,π-сопряжение), содержащую шесть электронов. Бензол представляет собой плоский правильный шестиугольник с длиной связи углерод-углерод 0,14нм, связи углерод-водород 0,11нм, валентными углами 120 0:

Молекула бензола стабильнее циклических соединений с изолированными двойными связями, поэтому бензол и его гомологи склонны к реакциям замещения (бензольное кольцо сохраняется), а не присоединения и окисления.
Сходство в строении и свойствах (ароматичность) с бензолом проявляют и другие циклические соединения. Критерии ароматичности (Э. Хюккель, 1931г.):
а) плоская циклическая структура, т.е. атомы, образующие цикл, находятся в sр 2 -гибридизации; б) сопряженная электронная система; в) число электронов (N) в кольце равно 4n+2, где n - любое целочисленное значение - 0,1,2,3 и т.д.
Критерии ароматичности применимы как к нейтральным, так и заряженным циклическим сопряженным соединениям, поэтому ароматическими соединениями будут, например:
фуран катион циклопропенила.
Для бензола и других ароматических соединений наиболее характерны реакции замещения атомов водорода при углеродных атомах в цикле и менее характерны реакции присоединения по π-связи в цикле.
Физические свойства.
Бензол и его гомологи являются бесцветными жидкостями и кристаллическими веществами со своеобразным запахом. Они легче воды и плохо в ней растворяются. Бензол неполярное соединение(μ=0), алкилбензолы -
полярные соединения(μ≠0).
Химические свойства.
Электрофильное замещение. Наиболее характерным превращением для аренов является электрофильное замещение - S Е. Реакция протекает в две стадии с образованием промежуточного σ-комплекса:
Условиях реакции: температура 60-80 0 С, катализаторы - кислоты Льюса или минеральные кислоты.
Типичные S Е - реакции:
а) галогенирование (Cl 2 , Br 2):
б) нитрование:
в ) сульфирование (H 2 SO 4 , SO 3 , олеум):
г) алкилирование по Фриделю-Крафтсу (1877г.) (RНal, ROH, алкены):
д) алкилирование по Фриделю-Крафтсу (галогенангидриды, ангидриды карбоновых кислот):
У гомологов бензола в результате влияния бокового радикала (+I-эффект, электронодонорная группа) π-электронная плотность бензольного кольца распределена неравномерно, увеличиваясь в 2,4,6-положениях. Поэтому S Е -реакции протекают направлено (в 2,4,6- или о- и п- положения). Гомологи бензола по сравнению с бензолом в реакциях этого типа проявляют большую реакционная активность.
толуол п -хлортолуол о -хлортолуол
Реакции боковых радикалов в алкилбензолах (радикальное замещение - S R и окисление).
Реакции радикального замещения протекают, как и в предельных углеводородах, по цепному механизму и включают стадии инициирования, роста и обрыва цепи. Реакция хлорирования протекает ненаправлено, реакция бромирования региоселективна - замещение водорода происходит уα-углеродного атома.
В алкилбензолах боковая цепь окисляется перманганатом калия, бихроматом калия с образованием карбоновых кислот. Независимо от длины боковой цепи, окисляется атом углерода, связанный с бензольным ядром (α-углеродный или бензильный атом углерода), остальные атомы углерода окисляются до СО 2 или карбоновых кислот.
этилбензол бензойная кислота
п -метилэтилбензол терефталевая кислота
Реакции бензола с нарушением ароматической системы.
Ароматические углеводороды имеют прочный цикл, поэтому реакции с нарушением ароматической системы (окисление, радикальное присоединение) протекают в жестких условиях (высокие температуры, сильные окислители).
а) радикальное присоединение:
1. гидрирование
![]()
толуол циклогексан
2. хлорирование

бензол 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Продукт этой реакции представляет смесь пространственных изомеров.
Ориентация электрофильного замещения в ароматических соединениях. Заместители в бензольном кольце по своему ориентирующему влиянию делятся на два типа: орто -, пара -ориентанты (заместители 1 рода) и мета -ориентанты (заместители 2 рода).
Заместители 1 рода - это электронодонорные группы, которые повышают электронную плотность кольца, увеличивают скорость реакции электрофильного замещения и активируют бензольное кольцо в этих реакциях:
D(+I-эффект): - R, -СН 2 ОН, -СН 2 NН 2 и т.д.
D(-I,+М-эффекты): -NH 2 ,-OH, -OR, -NR 2 , -SH и т.д.
Заместители 2 рода – электроноакцепторные группы, которые понижают электронную плотность кольца, уменьшают скорость реакции электрофильного замещения и дезактивируют бензольное кольцо в этих реакциях:
А (-I-эффект): -SO 3 H, -CF 3 , -CСl 3 и т.д.
А (-I, -М -эффект): -НС=О, -СООН, -NO 2 и т. д.
Атомы галогенов занимают промежуточное положение - они понижают электронную плотность кольца, уменьшают скорость реакции электрофильного замещения и дезактивируют бензольное кольцо в этих реакциях, однако это о -,п -ориентанты.
Если в бензольном кольце находится два заместителя, то их ориентирующее действие может совпадать (согласованная ориентация ) или не совпадать (несогласованная ориентация ). В реакциях электрофильного замещения соединения с согласованной ориентацией образуют меньшее количество изомеров, во втором случае образуется смесь из большего числа изомеров. Например:
 п
-
гидроксибензойная
кислота м
-
гидроксибензойная
кислота
п
-
гидроксибензойная
кислота м
-
гидроксибензойная
кислота
(согласованная ориентация) (несогласованная ориентация)
Полициклические конденсированные ароматические углеводороды (нафталин, антрацен, фенантрен и т.д.), в основном, по свойствам похожи на бензол, но вместе с тем имеют некоторые отличия.
Применение:
1. ароматические углеводороды - сырье для синтеза красителей, взрывчатых веществ, лекарственных препаратов, полимеров, поверхностно-активных веществ, карбоновых кислот, аминов;
2. жидкие ароматические углеводороды хорошие растворители органических соединений;
3. арены - добавки для получения высокооктановых бензинов.
Знаете ли вы, что -В 1649 году немецкий химик Иоганн Глаубер впервые получил бензол.
В 1825 году М. Фарадей выделил из светильного газа углеводород и установил его состав - С 6 Н 6 .
В 1830 году Юстус Либих назвал полученное соединение бензолом (от араб. Вen-аромат + zoa-сок + лат. ol-масло).
В1837 году Огюстом Лораном назван радикал бензола С 6 Н 5 - фенил (от греч phenix-освещать).
В 1865 году немецкий химик-органик Фридрих Август Кекуле предложил формулу бензола с чередующимися двойными и одинарными связями в шестичленном цикле.
В 1865-70-х годах В. Кернер предложил использовать приставки для обозначения взаимного расположения двух заместителей: 1,2 положение - орто- (orthos - прямой);1,3- мета (meta - после) и 1,4- пара (para - напротив).
Ароматические углеводороды - высокотоксичные вещества, вызывают отравление и поражение некоторых органов, например почек, печени.
Некоторые ароматические углеводороды - канцерогены (вещества, вызывающие раковые заболевания), например бензол (вызывает лейкемию), один из сильнейших - бензопирен (содержится в табачном дыме).
ТЕМА 20. Ароматические углеводороды ряда бензола.
Гомологический ряд. Общая формула. Номенклатура. Изомерия.
Природные источники и методы получения: из алифатических, алициклических и ароматических соединений. Реакции Вюрца-Фиттига и Фриделя-Крафтса.
Физические свойства бензола и его гомологов.
Химические свойства. Реакции электрофильного замещения: галогенирование, нитрование, сульфирование, алкилирование и ацилирование. Реакции присое-динения водорода, галогенов, озона. Окисление бензола. Реакции гомологов бензола с участием боковой цепи: галогенирование, нитрование, окисление, дегидрирование.
Гомологический ряд. Общая формула.
Первым и наиболее важным представителем моноциклических ароматических углеводородов (аренов) является бензол С 6 Н 6 .
Отсюда общее название гомологического ряда ароматических углеводородов - ряд бензола.
Общая формула гомологического ряда бензола: С п Н 2п-6 .
Номенклатура аренов.
Для наименования аренов часто используются тривиальные названия: бензол, толуол, стирол, кумол и т.д.
По международной заместительной номенклатуре арены рассматриваются как производные бензола, в которых положение заместителей указывается цифрами, при этом номера атомов углеродов, у которых расположены заместители должны быть наименьшими:
метилбензол этилбензол изопропилбензол
(толуол) (кумол)

винилбензол этинилбензол
(стирол) (фенилацетилен)
В случае двух одинаковых заместителей вместо цифр можно пользоваться приставками: 1,2- (орто-), 1,3- (мета-), 1,4- (пара-):

1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол
(орто-ксилол) (мета-ксилол) (пара-ксилол)
















